肝细胞癌(Hepatocellular carcinoma, HCC)是一种侵袭性强的恶性肿瘤,其发病率和死亡率均居高位。H3Q5ser是一种由转谷氨酰胺酶2(TGM2)介导的基于血清素的组蛋白修饰,影响多种生物过程,但TGM2介导的H3Q5ser在HCC进展中的作用尚不清楚。2025年1月7日,华中科技大学同济医学院附属同济医院陈孝平院士、张必翔教授和张学武教授团队在Journal of Hepatology(IF=26.8)发表了题为“TGM2-mediated histone serotonylation promotes HCC progression via MYC signalling pathway”的文章,旨在研究TGM2在HCC进展中的作用,发现TGM2可作为预后生物标志物,靶向其转谷氨酰胺酶活性可能是抑制HCC进展的有效策略。
· 维真助力 - AAV ·
基因信息
H3.3:组蛋白H3.3
Tgm2:转谷氨酰胺酶2
实验动物
C57BL/6J小鼠,TGM2条件性敲除小鼠
病毒产品
AAV8-H3.3-WT,AAV8-H3.3 (Q5A), AAV8-Tgm2-WT-NLS,AAV8-Tgm2 (W241A)-NLS
注射剂量
5×1011 vg/mouse in 200μl PBS
注射方式
尾静脉注射
01 研究结果
1、核定位TGM2在体外和体内促进HCC的发生和进展
研究人员发现与非肿瘤组织相比,5-HT在HCC肿瘤组织中积累;TGM2可以使用5-HT介导蛋白质的血清素化,进一步探究了TGM2在肝细胞癌中的表达模式,体外实验表明,TGM2过表达显著促进了HCC细胞的体外增殖,并且诱导了HCC细胞迁移和侵袭,而TGM2敲除显著抑制了其增殖。同样,TGM2过表达显著促进了皮下异种移植物小鼠模型中HCC细胞的生长。此外,在DEN诱导的HCC和SB介导的尾静脉高压注射( HTVI )模型中,TGM2促进HCC的发生和进展。肝脏特异性Tgm2敲除小鼠没有明显的肿瘤形成,存活率也有所提高。以上结果表明,TGM2在体外和体内促进HCC的发生和进展。
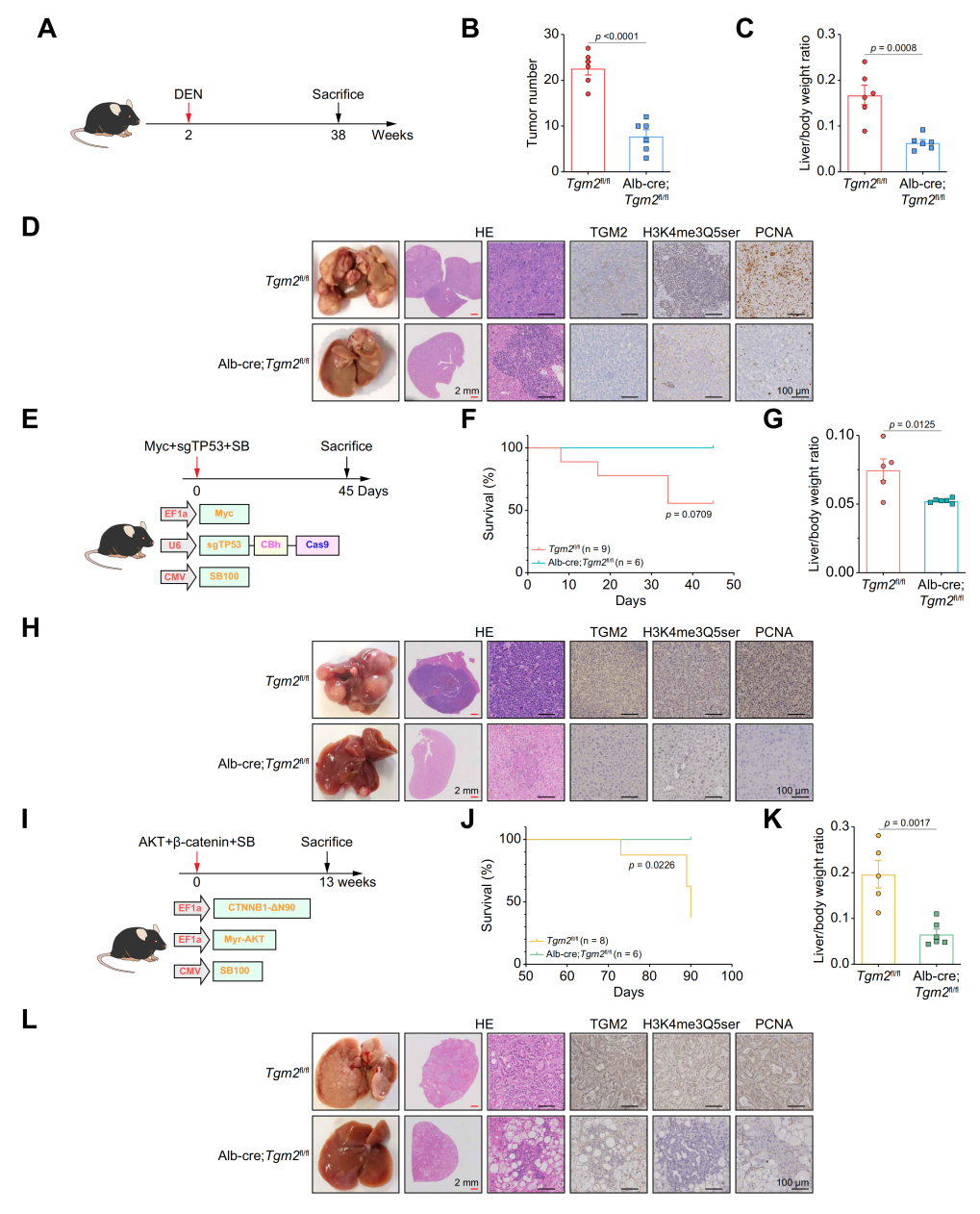
图1. Tgm2缺乏会抑制小鼠模型中HCC的进展
2、TGM2通过其转谷氨酰胺酶活性介导的H3Q5ser修饰促进HCC进展
TGM2与H3Q5ser修饰密切相关,研究人员进一步探究了其转谷氨酰胺酶活性介导的H3Q5ser修饰在HCC进展中的作用。实验表明,在过表达TGM2且具有完整转谷氨酰胺酶活性的组中,HCC细胞的增殖最快,并在皮下异种移植物小鼠模型体内显示了类似的结果。随后生成了过表达野生型H3.3和突变体(Q5A & Q5E)的HCC细胞系,突变体细胞系肿瘤的形成在体内外受到抑制。此外,通过AAV8在TGM2条件性敲除(CKO)小鼠中建立了肝脏特异性过表达野生型TGM2或突变体TGM2(W241A)的模型小鼠,并进行了HTVI实验,结果表明,过表达具有完整转谷氨酰胺酶活性的TGM2组小鼠具有最大的肿瘤形成和最差的存活率。同样,利用野生型C57BL/6J小鼠构建了肝脏特异性过表达野生型H3.3或突变型H3.3(Q5A)的小鼠。进一步的HTVI实验表明,突变型H3.3可以抑制肿瘤形成并提高存活率。总体而言,以上发现表明TGM2通过转谷氨酰胺酶活性介导的H3Q5ser修饰促进HCC进展。
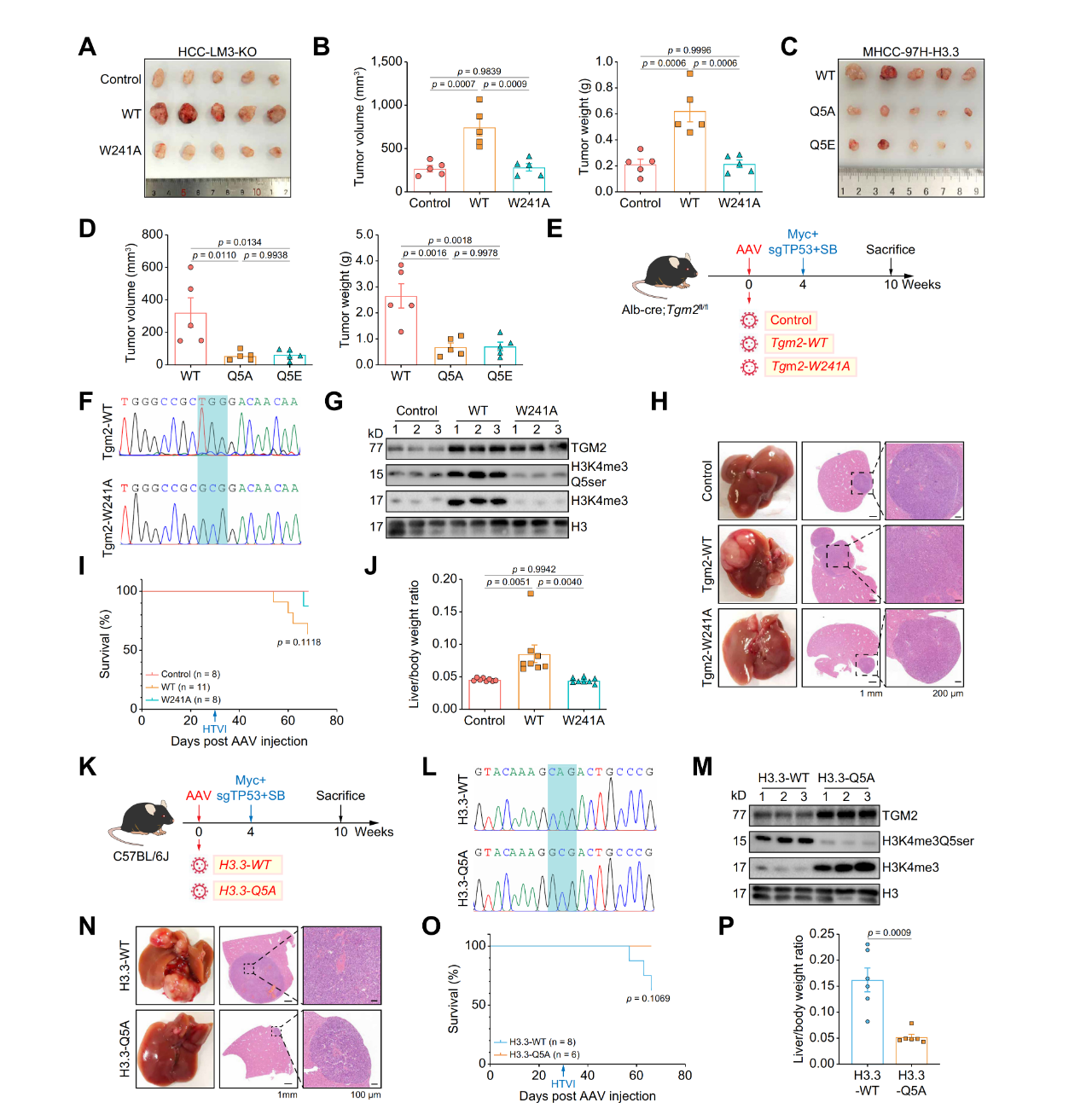
图2. TGM2转谷氨酰胺酶活性介导的H3Q5ser修饰在体内促进HCC进展
3、TRIM28介导TGM2向MYC的募集,通过H3Q5ser修饰促进MYC靶基因的转录
研究人员进一步发现核定位TGM2介导的H3Q5ser修饰增强了MYC基因的转录,并探究其调控机制。鉴定了TGM2的相互作用因子,发现TRIM28可能与TGM2结合,并且TRIM28介导了TGM2向MYC的募集。通过co-IP测定,在内源性和外源性水平上证实了三种蛋白质之间的相互作用,且TRIM28与MYC靶基因的启动子结合。此外,MYC或TRIM28敲除下调了MYC靶基因上的H3K4me3和H3Q5ser水平。TRIM28敲除降低了MYC靶基因的转录,而没有下调TGM2和MYC的表达。表明TRIM28 介导了TGM2对MYC信号通路的调节。进一步实验证明了TRIM28通过介导TGM2向MYC的募集,促进MYC靶基因上H3Q5ser的修饰。
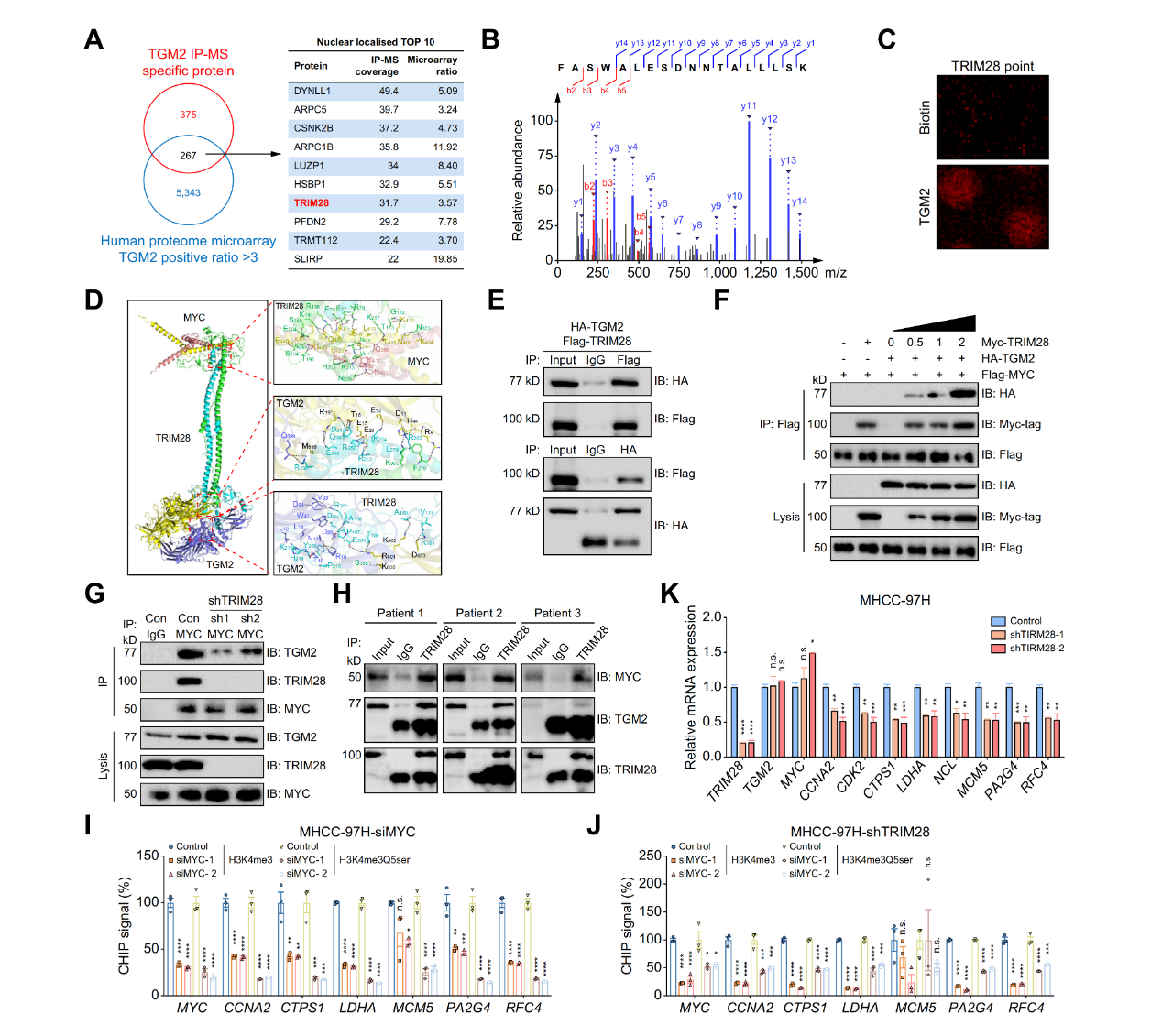
图3. TRIM28介导MYC募集TGM2以促进MYC靶基因上的H3Q5ser修饰
02 结论
本研究首次揭示了 TGM2 介导的组蛋白血清素化在肝癌进展中的重要作用及相关机制。TGM2通过催化组蛋白发生血清素化修饰,激活MYC信号通路,进而促进肝癌细胞的增殖和肿瘤的生长。这一发现为肝癌的发病机制提供了全新的视角,也为开发针对肝癌的新型治疗策略提供了潜在的靶点。未来,或许可以通过干预TGM2的活性或组蛋白血清素化过程,来实现对肝癌的精准治疗,为广大肝癌患者带来新的希望。
